高中_化学_化学选修_选修5_高中化学选修3选修4选修5人教版_高中化学(人教版,选修4)第一章化学反应与能量第一节第1课时
类型:
大小:112 KB
页数:5页
ID:640bd0d0aed39
第1页 / 共5页

第2页 / 共5页

第3页 / 共5页
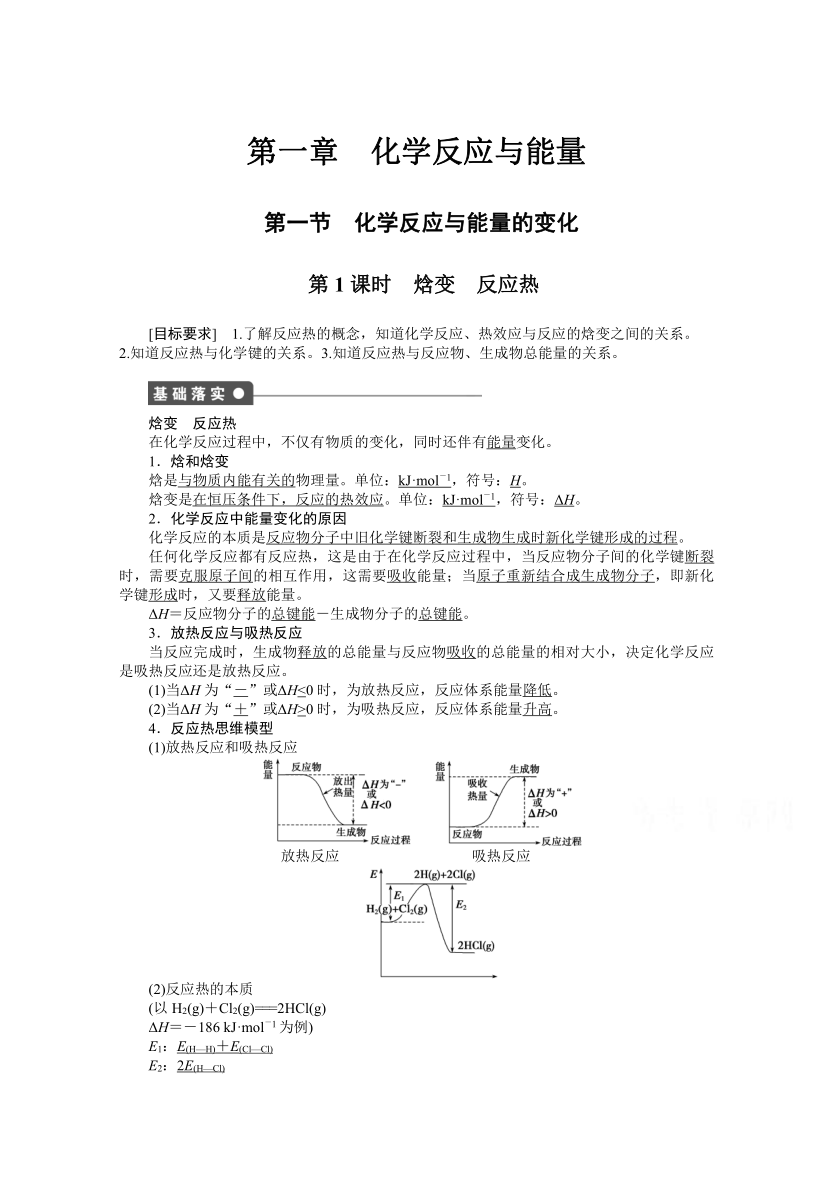
.ks5u.第一章 化学反应与能量第一节 化学反应与能量的变化第1课时 焓变 反应热[目标要求] 1.了解反应热的概念,知道化学反应、热效应与反应的焓变之间的关系。2.知道反应热与化学键的关系。3.知道反应热与反应物、生成物总能量的关系。INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\基础落实.TIF"\*MERGEFORMAT焓变 反应热在化学反应过程中,不仅有物质的变化,同时还伴有能量变化。1.焓和焓变焓是与物质内能有关的物理量。单位:kJ·mol-1,符号:H。焓变是在恒压条件下,反应的热效应。单位:kJ·mol-1,符号:ΔH。2.化学反应中能量变化的原因化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。ΔH=反应物分子的总键能-生成物分子的总键能。3.放热反应与吸热反应当反应完成时,生成物释放的总能量与反应物吸收的总能量的相对大小,决定化学反应是吸热反应还是放热反应。(1)当ΔH为“-”或ΔH<0时,为放热反应,反应体系能量降低。(2)当ΔH为“+”或ΔH>0时,为吸热反应,反应体系能量升高。4.反应热思维模型(1)放热反应和吸热反应INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\S1A.TIF"\*MERGEFORMAT INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\S1B.TIF"\*MERGEFORMAT 放热反应 吸热反应INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\S1.TIF"\*MERGEFORMAT(2)反应热的本质(以H2(g)+Cl2(g)===2HCl(g)ΔH=-186kJ·mol-1为例)E1:E(H—H)+E(Cl—Cl)E2:2E(H—Cl)ΔH=E1-E2 INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\对点训练.TIF"\*MERGEFORMAT知识点一 有关反应热的概念1.下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.放热反应在常温下一定很容易发生C.吸热反应在一定的条件下也能发生D.焓变的符号是ΔH,单位是kJ·mol-1,反应热的单位是kJ* C2.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是( )A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应B.水分解产生*气和氧气时放出能量C.相同状况下,反应2SO2+O2===2SO3是一个放热反应,则反应2SO3===2SO2+O2是一个吸热反应D.*化*分解成*气和*气时放出能量* C解析 由题意可以推测,如果一个反应过程放出能量,那么使该反应向反方向进行则需要吸收能量,所以C正确;另外*气和氧气反应、*气和*气反应、铝和氧气反应都是放出能量的反应,与它们相反的反应:水、*化*和Al2O3的分解都应该是吸收能量的反应,故A、B、D错误。知识点二 反应热与化学键键能的关系3.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):化学键H—HCl—ClCl—H键能/(kJ·mol-1)436243431请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )A.+862kJ·mol-1B.+679kJ·mol-1C.-183kJ·mol-1D.+183kJ·mol-1* C解析 拆开1molH2和1molCl2中的化学键所吸收的能量是436kJ·mol-1+243kJ·mol-1=679kJ·mol-1;形成2molHCl所放出的能量是431kJ·mol-1×2=862kJ·mol-1,所以该反应的反应热是679kJ·mol-1-862kJ·mol-1=-183kJ·mol-1。4.白*的化学式为P4,分子的空间构型是正四面体(如图)。白*在空气中燃烧生成十氧化四*(P4O10),在十氧化四*分子里只存在P—O和P===O两种共价键。INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\S2.TIF"\*MERGEFORMAT已知几种共价键的键能:P—O360kJ·mol-1;P===O585kJ·mol-1;P—P198kJ·mol-1;O===O498kJ·mol-1。请问:在P4(s)+5O2(g)===P4O10(s)中,ΔH=______________。* -2982kJ·mol-1解析 由P4的分子结构和P4+5O2eq\o(=====,\s\up7(点燃))P4O10的物质变化,在P4O10分子中只存在P—O和P===O两种共价键,P4O10中P显+5价、O显-2价等事实可知,在P4分子结构的基础上,每2个P原子之间*入1个O原子形成2个P—O键,每个P原子再结合1个O原子形成P===O键,就构成了P4O10的分子结构。这样,在1个P4O10分子*有12个P—O键、4个P===O键。ΔH=反应物键能总和-生成物键能总和=6×198kJ·mol-1+5×498kJ·mol-1-(12×360kJ·mol-1+4×585kJ·mol-1)=-2982kJ·mol-1。知识点三 反应热与反应物、生成物总能量的关系5.对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )A.EA>EBB.EA>EB+ECC.EA+EB>EC+EDD.EA+EB<EC+ED* C解析 反应物所具有的总能量高于生成物所具有的总能量,在发生化学反应时,有一部分能量会转变成热能释放出来,这类反应即为放热反应。6.INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\S3.TIF"\*MERGEFORMAT由上图分析,有关叙述正确的是( )A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等B.A―→B+C是放热反应C.A具有的能量高于B和C具有的能量总和D.A―→B+C是吸热反应,则B+C―→A必然是放热反应* D解析 本题考查化学反应中的能量变化,由图可知,B+C的能量高于A的能量,则反应B+C―→A一定是放热反应;反之,A―→B+C则是吸热反应。根据能量守恒定律,两反应的反应热在数值上相等,符号相反。INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\课时作业.TIF"\*MERGEFORMATINCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\左括.TIF"\*MERGEFORMAT练基础落实INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\右括.TIF"\*MERGEFORMAT1.下列说法不正确的是( )A.任何化学反应都伴随着能量变化B.化学反应中的能量变化都表现为热量变化C.反应物的总能量高于生成物的总能量时,发生放热反应D.反应物的总能量低于生成物的总能量时,发生吸热反应* B解析 任何化学反应都伴随着能量变化,但能量变化不一定表现为热量变化,还可能以光能等其他形式的能量放出;E(反应物)>E(生成物),反应放热,E(反应物)<E(生成物),反应吸热。2.已知H—H键键能(断裂时吸收或生成时释放的能量)为436kJ·mol-1,H—N键键能为391kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是( )A.431kJ·mol-1B.945.6kJ·mol-1C.649kJ·mol-1D.896kJ·mol-1* B解析 ΔH=反应物键能总和-生成物键能总和ΔH=3×E(H—H)+E(N≡N)-6E(N—H)=3×436kJ·mol-1+E(N≡N)-6×391kJ·mol-1=-92.4kJ·mol-1,所以E(N≡N)=-92.4kJ·mol-1+6×391kJ·mol-1-3×436kJ·mol-1=945.6kJ·mol-1。3.已知*气在*气中燃烧时产生苍白*火焰。在反应过程中,破坏1mol*气中的化学键消耗的能量为Q1kJ,破坏1mol*气中的化学键消耗的能量为Q2kJ,形成1mol*化*中的化学键释放的能量为Q3kJ,下列关系式正确的是( )A.Q1+Q2>Q3B.Q1+Q2>2Q3C.Q1+Q2<Q3D.Q1+Q2<2Q3* D解析 根据能量守恒原理:破坏化学键吸收的能量-形成新化学键放出的能量=反应热。对于该放热反应:ΔH<0,则Q1+Q2-2Q3<0,故Q1+Q2<2Q3。INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\左括.TIF"\*MERGEFORMAT练方法技巧INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\右括.TIF"\*MERGEFORMAT思维模型的运用4.INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\S4.tif"\*MERGEFORMAT已知H2(g)+eq\f(1,2)O2(g)===H2O(g)反应过程中能量变化如图,问:a、b、c分别代表什么意义?该反应是放热反应还是吸热反应,ΔH大于零还是小于零?* a代表旧键断裂吸收的能量,b代表新键生成释放的能量,c代表反应热;该反应为放热反应,ΔH<0。解析 H2(g)和eq\f(1,2)O2(g)与2H(g)和O(g)之间的能量差是H2(g)―→2H(g)和eq\f(1,2)O2(g)―→O(g)过程中断开H—H键和O===O键吸收的能量,故a代表旧键断裂吸收的能量,b代表2H(g)+O(g)结合成H2O(g)过程中化学键所放出的能量,c代表成键所释放的能量与断键吸收的能量之差;由图可知该反应中反应物总能量大于生成物总能量,故该反应为放热反应,ΔH<0。INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\左括.TIF"\*MERGEFORMAT练综合拓展INCLUDEPICTURE"E:\\同步练案\\人教化学选修4\\右括.TIF"\*MERGEFORMAT5.下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):物质Cl2Br2I2HClHBrHIH2能量(kJ)243193151432366298436根据上述数据回答(1)~(5)题。(1)下列物质本身具有的能量最低的是( )A.H2B.Cl2C.Br2D.I2(2)下列*化物中,最稳定的是( )A.HClB.HBrC.HI(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?答:____________________。(4)相同条件下,X2(X代表Cl、Br、I)分别与*气反应,当消耗等物质的量的*气时,放出或吸收的热量最多的是__________。(5)若无上表中的数据,你能正确回答出问题(4)吗?答:________,你的根据是__________________________________________________________________________________________________________________________。* (1)A (2)A (3)放热反应 (4)Cl2 (5)能元素的非金属*越强,生成的*化物越稳定,反应放出的热量就越多解析 破坏1mol物质的化学键时所消耗的能量与相同条件下由形成该物质的原子形成1mol该物质放出的能量相等,放出的能量越多,物质本身具有的能量越低,分子越稳定。(1)生成1molH2时放出的能量最多,为436kJ;(2)在*化物中,生成1molHCl时放出的能量最多,为432kJ;(3)分别计算出三个反应放出的热量依次为:185kJ、103kJ和9kJ。6.已知1g*气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO===O键完全断裂时吸收热量496kJ,水蒸气中1molH—O键形成时放出热量463kJ,则*气中1molH—H键断裂时吸收热量是________。* 436kJ解析 因为1g*气完全燃烧生成水蒸气时放出热量121kJ,所以1molH2与eq\f(1,2)molO2完全燃烧生成1mol水蒸气时放出热量242kJ。而化学反应中之所以存在能量的变化是因为在化学反应过程中存在旧键的断裂与新键的形成,其中旧键的断裂需要吸收能量而新键的形成需要放出能量。发生上述反应H2(g)+eq\f(1,2)O2(g)===H2O(g) ΔH=-242kJ·mol-1时所发生键的变化为断裂1molH—H键和eq\f(1,2)molO===O键、形成2molO—H键,因此在此反应过程中断裂旧键需要吸收的能量为eq\f(1,2)×496kJ+E(H—H),形成新键释放的能量为2×463kJ=926kJ,此反应为放热反应,所以有926kJ-eq\f(1,2)×496kJ-E(H—H)=242kJ,解得E(H—H)=436kJ。
免费预览已结束,剩余 2 页可下载查看
点击下载本文档本文档为docx格式
下载文档